(1)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目可表示为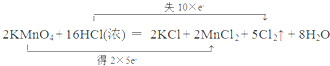 , 故答案为: 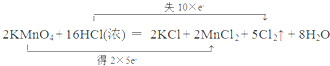 ; (2)由反应的化学方程式可知,当有amol HCl被氧化时,生成0.5amol5Cl2,则标准状况下的体积为11.2a L, 故答案为:11.2a L. |
(1)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目可表示为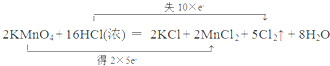 , 故答案为: 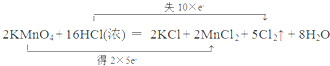 ; (2)由反应的化学方程式可知,当有amol HCl被氧化时,生成0.5amol5Cl2,则标准状况下的体积为11.2a L, 故答案为:11.2a L. |
题目简介
在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,(1)请用双线桥标出电子转移的方向和数目______;(2)当有amolHCl被氧化时,可产生的Cl2在标准状况下
题目详情
(1)请用双线桥标出电子转移的方向和数目______;
(2)当有amol HCl被氧化时,可产生的Cl2在标准状况下的体积为______.(用含a的代数式表示)