| ①BaCl2属离子晶体,只含离子键; ②金刚石属原子晶体,只含共价键; ③NH4Cl属离子晶体,含离子键、共价键、配位键; ④Na2SO4属离子晶体,含离子键、共价键; ⑤干冰属分子晶体,只含共价键; ⑥碘片属分子晶体,只含共价键; (1)熔化时不需要破坏化学键的是分子晶体,熔化时需要破坏共价键的是原子晶体. 故答案为:⑤⑥; ②. (2)根据以上分析,知属于离子化合物的是①③④;只有离子键的物质是①,故答案为:①③④; ① (3)氯化钡是离子化合物,书写电子式时要符合离子化合物的特点,干冰的成分是二氧化碳,是共价化合物,书写电子式时要符合共价化合物的特点,故答案为: 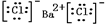 、 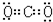 |
题目简介
现有①BaCl2、②金刚石、③NH4Cl、④Na2SO4、⑤干冰、⑥碘片六种物质,按下列要求回答:(1)熔化时不需要破坏化学键的是______,熔化时需要破坏共价键的是______,(2)属于离子化合
题目详情
(1)熔化时不需要破坏化学键的是______,熔化时需要破坏共价键的是______,
(2)属于离子化合物的是______,只有离子键的物质是______,
(3)①的电子式是______,⑤的电子式是______.